Teorien om elektrolytisk dissosiasjon. En enkel forklaring på komplekse prosesser
Med begrepet "elektrolytisk dissosiasjon" forskerejobber siden slutten av det nittende århundre. Hans utseende skyldes den svenske kjemikeren Arrhenius. Han arbeidet med elektrolyttproblemet i 1884-1887, og introduserte det for å beskrive fenomenet ionisering i løsninger og i dannelsen av smelter. Mekanismen for dette fenomenet bestemte han seg for å forklare dekomponeringen av molekyler i ioner, elementer som har en positiv eller negativ ladning.
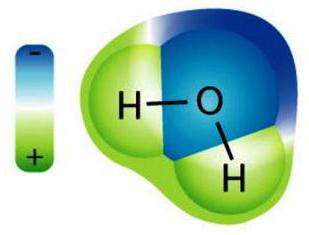
Teorien om elektrolytisk dissosiasjon forklarerelektrisk ledningsevne av noen løsninger. For eksempel, en typisk molekyl av dette salt oppløsning på kaliumioner som har en ladning med et skilt for KCl Kaliumklorid "pluss" (kation) og et klorion, en ladning med et tegn "minus" (anion). Saltsyre HCl deler seg i en kation (hydrogen-ion) og et anion (kloridion), natronlut Naho fører til natriumioner og et anion som hydroksydion. De viktigste bestemmelsene av teorien av elektrolytisk dissosiasjon beskrive oppførselen til ioner i oppløsninger. I henhold til denne teori, at de beveger seg helt fritt i løsning, og til og med en liten dråpe av oppløsningen blir understøttet av en jevn fordeling av motsatt ladede elektriske ladninger.
Teorien om elektrolytisk dissosiasjonsprosessDannelsen av elektrolytter i vandige løsninger er forklart som følger. Utseendet til frie ioner indikerer ødeleggelsen av krystallgitteret av materie. Denne prosessen når stoffet er oppløst i vann forekommer under påvirkning av polymolekyler av løsningsmidlet (i vårt eksempel vi vurderer vann). De er i stand til å redusere den elektrostatiske tiltrekningskraften som eksisterer mellom ioner i gitterstedene, noe som resulterer i at ioner beveger seg til en fri bevegelse i løsningen. I dette tilfellet faller frie ioner inn i miljøet av polar vannmolekyler. Dette skallet dannet rundt dem, teorien om elektrolytisk dissosiasjon kalles hydrering.
Men teorien om elektrolytisk dissosiasjon Arrheniusforklarer dannelsen av elektrolytter, ikke bare i løsninger. Krystallgitteret kan også ødelegges under påvirkning av temperatur. Oppvarming av krystallet, vi får effekten av intens oscillasjon av ioner på gitterstedene, som gradvis fører til ødeleggelsen av krystallet og utseendet av en smelte som helt består av ioner.
Tilbake til løsninger følger den separatvurdere eiendommen til et stoff, som vi kaller et løsemiddel. Den lyseste representanten for denne familien er vann. Hovedfunksjonen er tilstedeværelsen av dipolmolekyler, dvs. når fra den ene enden er molekylet positivt ladet, og fra det andre er det negativt. Et vannmolekyl tilfredsstiller disse kravene, men vann er ikke det eneste løsningsmidlet.
Prosessen med elektrolytisk dissosiasjon kanog forårsake ikke-vandige polare oppløsningsmidler, f.eks, flytende svoveldioksyd, flytende ammoniakk, og så videre. Det er imidlertid vann som opptar hoved plass i denne serien på grunn av dens egenskap for svekkelse (oppløse) den elektrostatisk tiltrekning og ødelegge den krystallinske gitter vises spesielt lyse. Derfor, når det gjelder løsninger, mener vi væsker på vannbasis.
Dyp studie av egenskapene til elektrolytter tillattgå til konseptet om deres styrke og grad av dissosiasjon. Graden av dissosiasjon av elektrolytten er forholdet mellom antall dissocierte molekyler og deres totale antall. I potensielle elektrolytter er denne koeffisienten i området fra null til enhet, og graden av dissosiasjon lik null betyr at vi har å gjøre med ikke-elektrolytter. Å øke graden av dissosiasjon påvirkes positivt av en økning i temperaturen i løsningen.
Styrken av elektrolytter bestemmes av graden av dissosiasjonunder konstant konsentrasjon og temperatur. Sterke elektrolytter har en grad av dissosiasjon som nærmer seg enhet. Disse er veloppløselige salter, alkalier, syrer.
Teorien om elektrolytisk dissosiasjon gjorde det mulig å forklare et bredt spekter av fenomener som studeres innenfor rammen av fysikk, kjemi, fysiologi av planter og dyr og teoretisk elektrokjemi.
</ p>