Hva er elektrodpotensialet?
Elektrodepotensialet er forskjellenelektrostatiske potensialer mellom elektrolytten og elektroden. Forekomsten av en slik kapasitet på grunn av spreng ladninger som er motsatt fortegn ved grenseflaten faseseparasjon slik at det dannes et elektrisk dobbeltlag.
Romlig adskillelse av kostnader ved grensenmellom metallelektroden og elektrolyttoppløsningen er forbundet med slike fenomen som overføringen av ioner fra metallet til løsningen under etableringen av elektrokjemisk likevekt, og også adsorpsjonen av ioner fra elektrolytten til elektrodeoverflaten; forskyvning av gass utover ionet positivt ladet krystallgitter; noncoulomb adsorpsjon av ioner eller molekyler av en væske på en elektrode. På grunn av de to siste fenomenene, er elektrodepotensialet aldri null, selv om ladningen av metalloverflaten er null. Den absolutte verdien av potensialet til en enkelt elektrode er ikke bestemt, for dette formål benyttes en metode for å sammenligne referanseelektroden og elektroden som skal testes. Elektrodpotensialet er likestilt med størrelsen på den elektromotoriske kraften (EMF) oppnådd i den elektrokjemiske krets.

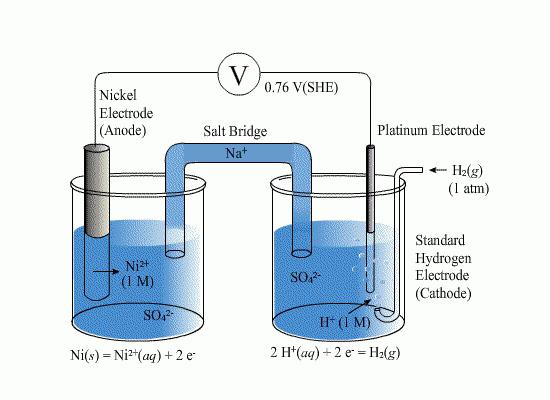
For vannbaserte løsningerbruk hydrogenelektroder. Standardelementer av denne typen brukes som standarder for en rekke elektrokjemiske målinger, samt i galvaniske enheter. En hydrogenelektrode er en ledning eller en plate av metall som absorberer gassformig hydrogenbrønn (palladium eller platina brukes ofte). En slik wireplate er mettet ved atmosfærisk trykk med hydrogen, hvoretter det nedsenkes i en vandig løsning rik på hydrogenioner. Potensialet til en slik plate er proporsjonal med konsentrasjonen av ioner i oppløsningen. Elementet er standarden, i forhold til det teller elektrodpotensialet av den kjemiske reaksjonen.
Ved montering av galvaniske celler på basenhydrogen og instrument definert i platinagruppemetalloverflate strømmer reaksjon (reversibel), som betyr eller gjenvinningsprosess eller oksydasjon. Type fremgangsmåte avhenger av kapasiteten av elementet pågående reaksjonen. hydrogen elektrodepotensialet blir bestemt til å være null når hydrogentrykket er ca. en atmosfære, protonkonsentrasjonen av løsningen - ett mol per liter, og temperatur - 298 K. Hvis det analyserte element i de oppgitte betingelser, dvs. når ioneaktivitet påvirker anleggets kapasitet, og gasstrykk - 0101 MPa, er denne verdien kalles en standard potensial.

Måle EMF av en galvanisk elektrode istandardbetingelser, beregnes standardelektrodepotensialet for den kjemiske reaksjonen. Vanligvis måles denne verdien under forhold når alle termodynamiske aktiviteter i den potensielle bestemmende reaksjonen er lik enhet, og gastrykket er 0,01 * 105Pa. Potensialet til elementet under test anses å være positivt dersom elektronikkene i den nåværende kildemodus i den eksterne kretsen beveger seg fra venstre til høyre og positivt ladede partikler i elektrolytten.</ p>
evaluering:





